私たちは「かたち」から様々な情報を獲得しています。空を飛ぶ鳥を見れば、たとえ初めて見る鳥であっても、チョウではなく、コウモリでもなく、鳥であると判断できます。時計職人は目の前の機械が正確に時を刻むことを「かたち」から判断し、研ぎ師は刃の切れの良さを刃先の「かたち」から判断します。「かたち」があたえる情報は膨大であり、化学の世界においても重要であることに変わりはありません。
私が専門とする構造生物化学は、タンパク質の「かたち」から、その働きを知る学問です。タンパク質は疎水性、親水性、酸性、塩基性、芳香族などの異なる性質をもつ20種類のアミノ酸が重合してできた高分子です。タンパク質は構成するアミノ酸の性質によってエネルギー的に安定な形に折り畳まれ、特定の立体構造を形成します。タンパク質は立体構造を形成することで、さまざまな機能を発揮します。タンパク質の立体構造を解明することで、タンパク質の働きを理解することができます。
今回、比較的知られている「構造生物学」ではなく、あえて「構造生物“化”学」と称しているのは、タンパク質の構造と機能を化学で説明することを目指しているからです。タンパク質の構造を調べる方法はいくつもありますが、化学で説明するためには原子が識別可能な分解能(原子分解能)で構造を決定することが必要です。原子分解能を目指して、結晶構造解析や近年発展が目覚ましいクライオ電子顕微鏡単粒子解析を用いて研究に取り組んでいます。
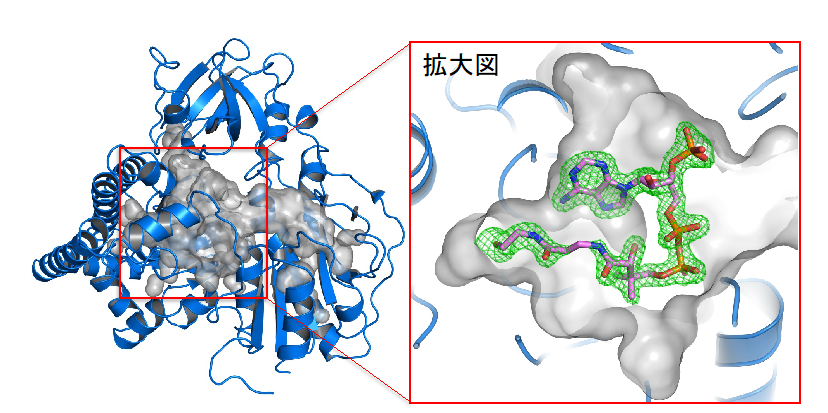
図1. HypXの結晶構造(リボンモデル)と分子内にある空洞(灰色)を示している。右の拡大図では、実験的に得られた電子密度(緑のメッシュ)とCoA(スティックモデル)を示している。
ここでは構造生物化学研究の一例として、私が決定したHypXという酵素の結晶構造を示しています (図1A)。HypXは一部のバクテリアが有する一酸化炭素合成酵素です。細胞内で一酸化炭素を合成することは決して珍しいことではなく、ヒトの細胞の中でも起きています。しかし、これまで知られていた一酸化炭素生合成反応は全て鉄などの金属が関与していました。HypXについても金属が関与する可能性が指摘されていましたので、得られた電子密度マップ(X線結晶構造解析によって得られる電子雲)から金属の電子雲を探しましたが見つかりません。その代わりに、タンパク質の内部に形成された空洞に明瞭な低分子の電子密度が見られました (図1の拡大図を参照)。この電子密度は補酵素Aの構造に一致しました。補酵素Aを端緒に分子動力学シミュレーションを含む追加実験を重ねて、生体反応では初めてとなる金属が関与しない(補酵素Aが関与する)新規な一酸化炭素生合成機構を提唱しました。
今回ご紹介した研究は、すぐに応用に結びつくものではありませんが、構造生物化学的手法は医薬品開発や生体触媒開発など様々な分野に応用されています。抗インフルエンザ薬 タミフルは、構造を基盤とした薬剤設計 (SBDD; Structure-Based Drug Design) によって開発されました(図2)。最近では、COVID-19に対するワクチン開発にクライオ電子顕微鏡単粒子解析が使われています。
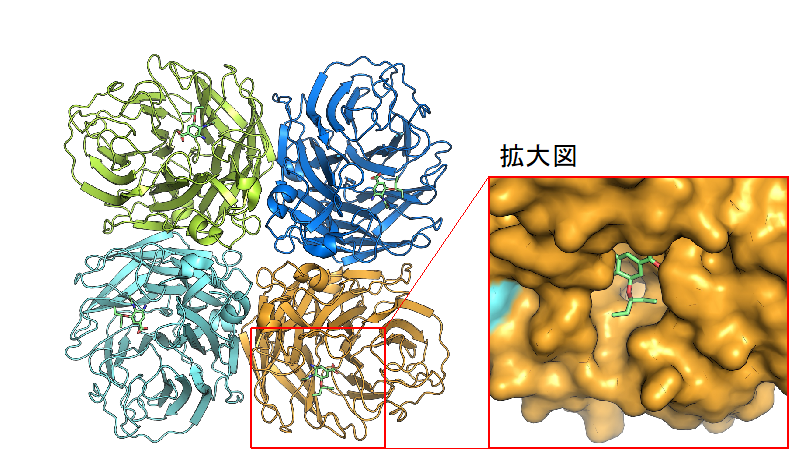
図2. インフルエンザウイルス由来ノイラミニダーゼ(リボンモデル)とタミフル(スティックモデル)の構造
構造生物化学は化学だけでなく、生命科学や計算科学、医学、薬学、あるいは放射光科学や顕微鏡学などの専門家との連携が欠かせません。さらに、AlphaFold2のようなAIを使った構造予測・構造設計も盛んになってきました。専門性は高いですが、開かれた分野ですので、興味をもっていただければ幸いです。




