イオン液体とは中性分子である水などの溶媒を一切含まず、イオンのみから構成される液体です。例えば、ナトリウムイオンと塩化物イオンからなる塩化ナトリウムは室温では固体(イオン結晶)ですが、融点である801 °C以上になると融解してイオン液体(または溶融塩)になります。陽イオンと陰イオンの組み合わせによっては、融点の低下により、室温でもイオン液体となる塩があります。このように室温以下の融点をもつ塩は従来、室温溶融塩または常温溶融塩と呼ばれていましたが、近年は単にイオン液体と呼ばれることが多くなっています。
一般に、陽イオンと陰イオンの電荷密度が低くなると、それらの間に働く静電相互作用が弱まり融点が低下します。このため多くのイオン液体はかさ高いイオンを組合わせることによって得られます。例えば、図1に示す1-ブチル-1-メチルピロリジニウム・ビス(フルオロスルホニル)アミドの融点は–18 °Cと報告されています。文献上、最初に報告されたイオン液体は、1914年にワルデンによって発見された硝酸エチルアンモニウムとされており、その融点は13〜14°Cと記されています。これまでに多種多様な陽イオンと陰イオンとの組み合わせによって無数のイオン液体が発見されています。イオン液体の性質は陽イオンと陰イオンの組み合わせに依存するため、目的や用途に合わせてイオン液体を設計することも試みられてきました。このようにイオン液体はデザインできる液体として注目を集めています。
電気化学は電気エネルギーと化学エネルギーを電極反応を通じて相互に変換する技術の基礎となる学問分野です。スマートフォンやノート型パソコンといった情報通信機器、電気自動車などに広く用いられているリチウムイオン電池も電気化学デバイスの一つです。多くのリチウムイオン電池には可燃性の有機溶媒を用いた電解液が使用されているため、事故が発生するとリチウムイオン電池が発火や爆発する恐れがあります。イオン液体は難揮発性かつ難燃性であることから、イオン液体を電解液に用いることでリチウムイオン電池の安全性が向上すると期待されています。
一方でイオン液体中での電気化学には未解明の部分が数多くあります。例えば、イオン液体中でのイオンの移動ひとつとっても、一般的な溶液系とは異なり、イオン間の静電相互作用の影響が顕著に表れます。イオン液体中での電気化学を研究することでこれまでにない新たな学理と技術が見出される可能性があります。
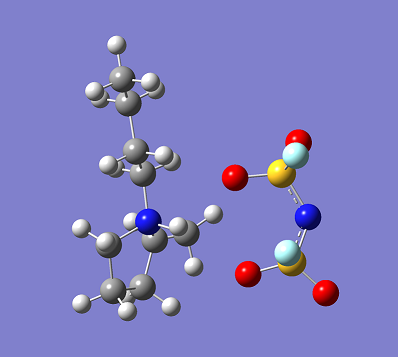
図1 1-ブチル-1-メチルピロリジニウム・ビス(フルオロスルホニル)アミドの分子構造。



