鈴木 孝治 (応用化学科 教授)
近年の目覚ましいバイオ研究の発展のなかで、生体の中で見たいものだけを可視化する技術であるバイオイメージングの発展が著しい。この研究で特にターゲットになるのは、細胞の中や生体内で重要な役割を果たしているタンパク質やDNAなどで、特にがん組織のような人間に害を与える部分やそれを発症するメカニズムを知るためにさまざまな目的分子を見るための技術である。この中で現代の研究として重用視されているのは、蛍光を用いたバイオイメージングである。その際、蛍光を発する小分子やタンパク質である蛍光物質がバイオイメージングのツールとして重要な役割をしており、見たいところだけにラベル化するレポーター蛍光分子や蛍光タンパク質、さらには見たいものを見られるようにするという機能をもつ蛍光分子プローブなどがある。蛍光分子や蛍光プローブを使ってバイオイメージングを行う場合、生体深部からの光は生体中の物質に吸収されてしまうので、650nmから900nmまでの近赤外窓(NIR Window I for bioimaging)と呼ばれる波長域の光が生体透過性が良く、この光領域に発光を示す蛍光分子が動物実験などの研究に必要とされている。
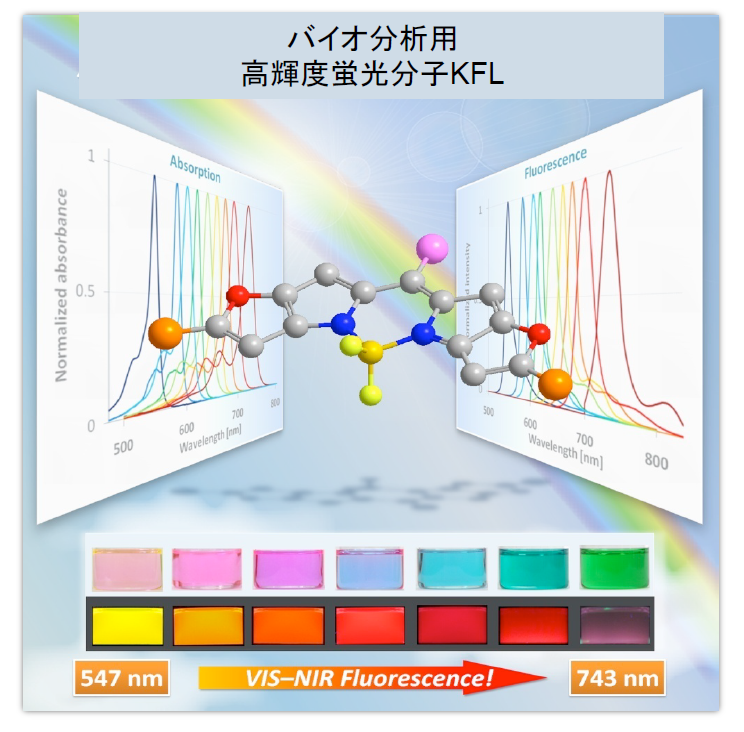
私達の分析研究室では、高輝度かつ近赤外窓域に強い発光を有する蛍光分子の開発に取り組み、KFL(Keio Fluorophore)と称する明るい蛍光分子を開発した。この分子は現在14種類あり、約500nmから近赤外窓域の740nmまでのさまざまな色の高輝度蛍光を発する材料として開発された。図に示すKFLはボロンジピロメテンをヘテロ環で拡張した構造であり、10万種を超えるさまざまな蛍光色素分子がある現在において最も明るい蛍光色素分子の類に入る(この蛍光分子KFLの光学性能を物理定数で表現すれば、モル吸光係数が20万〜30万、蛍光量子収率は0.5〜1で相当明るい蛍光分子である)。これをレポーター分子として用いると、細胞内や組織が明るく染色できるほか、分子の一部を工夫すればカルシウムや他のイオン、pHの分布などを可視化して見ることができる。
このような蛍光を用いるバイオイメージングの最大の欠点は、光を当てて蛍光を見るという点にあり、いわゆるバックグラウンド蛍光という周りが少し明るくなる現象を避けられない。そのため、私達の研究室では蛍光以外にこのようなバックグラウンド光の問題のない人工生物発光に近年取り組んでいる。ホタルや発光クラゲといった生物は、自身の化学反応(酸化反応)で光るタンパク質と基質を体内に備えており、これらが生物発光の源となっている。生物発光の研究ではノーベル賞を受章された下村脩先生の研究が著名である。化学の本質は、これまでできなかったもの、特に生体(天然物)を超える材料を作る、環境に配慮したものを作る、さらには環境にいくらでもある安全材料を使って有益なものを作る、などが21世紀の化学の役割であろう。人工生物発光の研究はそのひとつであり、生体を超える分子や材料を作るという点に重要性がある。私達の分析研究室では、東京大学、筑波大学、鹿児島大学などと組んで、人工タンパク質および新規基質(小分子)の有機合成を行ってきている。そのうちセレンテラジンを基質として新たな小分子をつくり、これと人工生物発光に有利な人工酵素ALucとを組み合わせると、今までの天然物よりも明るい生物発光をすることが認められた。また、これらを使ってがん部位のイメージングなど生体の奥深いところから近赤外光で観察できる人工生物発光系を確立しようと尽力している。研究室の学生達はこれらの目的をもってさまざまな構造の新規基質分子の設計と合成に取り組んでおり、着々と新たな人工生物発光に向かった研究が進みつつある。その中では発光クラゲの発光源であるセレンテラジンの誘導体(合成小分子基質)と人工酵素を用いた近赤外生物発光系もできており、今後は実際の生体イメージングに利用されると期待している。